【云南】药品上市后变更管理工作程序和要求(试行)的补充通告
7月23日,云南省药品监督管理局关于云南省药品上市后变更管理工作程序和要求(试行)的补充通告(2021年 第2号 )

2021年3月20日我局发布了《云南省药品监督管理局关于发布<云南省药品上市后变更管理类别沟通交流工作程序和要求(试行)>和<云南省药品上市后变更管理工作程序和要求(试行)>的通告》(2021年第1号),随着药品上市后变更工作的不断开展以及国家药品业务应用系统的不断优化,为进一步完善《云南省药品上市后变更管理工作程序和要求(试行)》相关工作内容,优化上市后变更工作流程,更好服务企业,现将《云南省药品上市后变更管理工作程序和要求(试行)》的有关修订内容通告如下:
一、将“第三条……行政审批处负责备案资料的受理及公示,药品化妆品注册处管理处(以下简称药化注册处)负责药品上市后变更管理的备案后审查及报告事项管理工作,省食品药品监督检验研究院(以下简称省食药检验院)……”修改为“第三条……行政审批处负责备案资料的签收及公示,药品化妆品注册处管理处(以下简称药化注册处)负责药品上市后变更管理的备案后审查及报告事项(注册事项变更)管理工作,药品化妆品生产监督管理处(以下简称药化生产处)负责药品生产场地变更涉及生产许可变更内容的管理工作,省食品药品监督检验研究院(以下简称省食药检验院)……”
二、将“第六条备案资料受理。省局行政审批处应当自持有人提交资料起5日内通过药品注册备案变更系统对持有人备案资料进行核对、受理及公示。经核对符合要求的,予以受理、公示;不符合要求的,不予受理、公示,并说明理由……”修改为“第六条备案资料签收、公示。省局行政审批处应当自持有人提交资料起5日内通过药品注册备案变更系统对持有人备案资料进行签收、公示。经核对符合要求的,予以签收、公示;不符合要求的,不予签收、公示,并说明理由……”
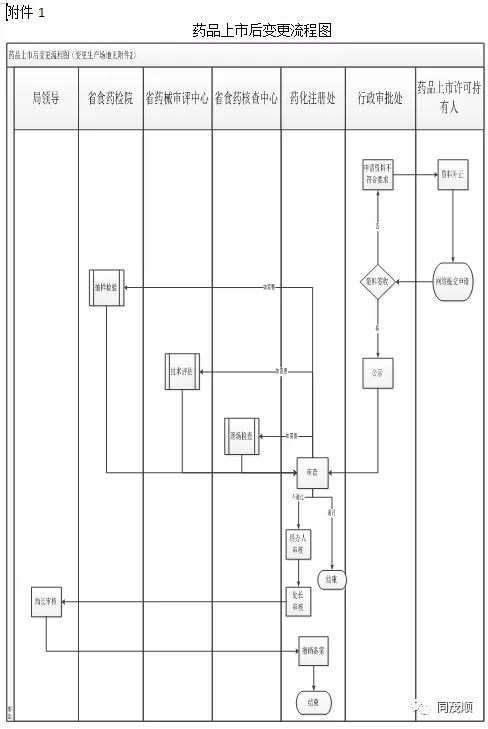
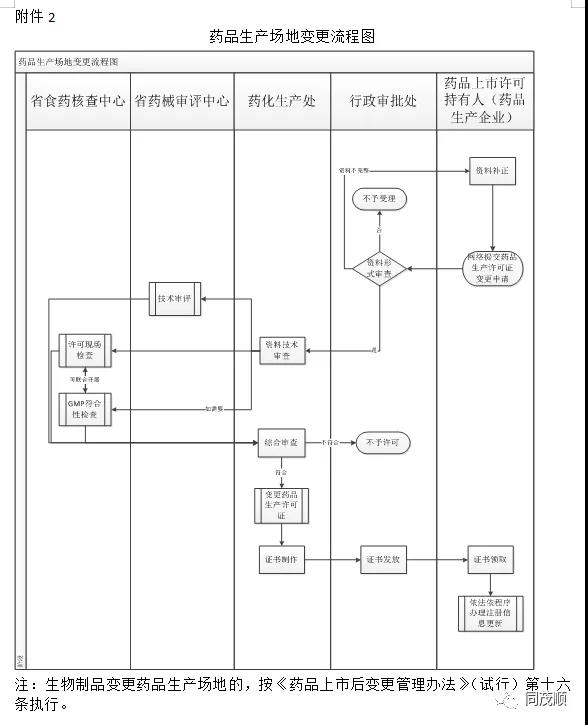
三、将《云南省药品上市后变更管理工作程序和要求(试行)》的附件2.1的药品上市后变更流程图进行修改(详见附件1)。四、将《云南省药品上市后变更管理工作程序和要求(试行)》的附件2.2的药品生产场地变更流程图进行修改(详见附件2)。
附件:1.药品上市后变更流程图
2.药品生产场地变更流程图
(本文来自网络,如有侵权请联系我们予以删除)